昂克素尔最新季报 :临床研究患者招募结束 CE认证加速推进
季报亮点多多 公司业绩斐然
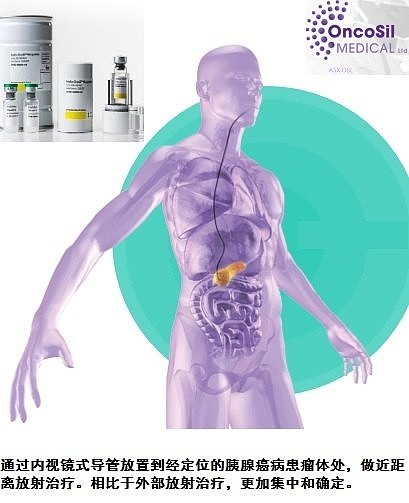
OncoPaC-1研究项目(美国)所有试验中心仍然在招募参与临床试验治疗的患者,已经招募6名,其中4名成功植入OncoSil™设备。
最新详细报告已经提交英国标准协会(BSI),报告陈述了OncoSil™设备的治疗情况和安全数据,推进了欧盟CE认证进展。
昂克素尔公司执行总裁丹尼尔•肯尼博士(Dr. Daniel Kenny)表示:“2018年二季度,公司的全球临床研究项目取得了里程碑式的进展,对此我们感到非常高兴。在成功招募50名患者后,胰腺癌研究项目PanCO患者招募工作已经结束,这些患者的早期治疗数据
良好。五月份,我们向英国标准协会提交了第一批25名患者的16周临床治疗报告,推进了欧盟CE认证进展。此外,患者的手术切除效果良好,我们对此感到振奋。这些都是里程碑式的临床试验治疗,因为它们证明,如果和化疗相结合的话,OncoSil™设备有可能使丧失手术治疗机会的患者重新获得手术治疗的机会。”

关于PanCO胰腺癌临床研究项目,昂克素尔公司已经成功完成PanCO胰腺癌临床研究项目患者招募工作,共招募50名患者,研究地点在澳大利亚,英国和比利时。在这50名患者中,41名成功植入OncoSil™ 设备。
结果表明,OncoSil™ 设备安全性良好,没有辐射毒性或其他安全隐患;通过EUS植入OncoSil™ 设备非常直接和顺利。
CE认证正加速推进
正如2018年5月14日公告所述,2018年5月11日,公司向英国标准协会(BSI)提交了详细报告,陈述了OncoSil™设备的治疗情况和安全数据。该协会监管公司的欧盟CE认证。这份报告提交了20名患者的补充数据,以支持前期提交的安全和疗效数据,满足了英国标准协会的要求。
英国标准协会目前正在按照欧盟相关法律和法规对该报告进行详细审查,以便进行欧盟CE认证。由于OncoSil™ 设备属于植入性放疗设备,英国标准协会需要时间对本公司5月11日提交的报告进行必要的尽职调查。这份报告向英国标准协会提供了当时所有参与试
验治疗的患者(46人)的OncoSil™设备和植入步骤的安全数据, 25名患者植入OncoSil™设备的疗效数据,以及8周和16周放疗评估数据。
现金余额较上季度增加450万澳元
季报还显示公司将于澳大利亚东部夏时制时间7月31日上午9:00召开全球投资者电话会议,讨论2018年2季度业绩情况以及公司未来发展前景。电话会议将由公司执行总裁丹尼尔•肯尼博士(Dr. Daniel Kenny)主持。
专业领域里的创新实践体现在资本市场必然是股价绩优,给投资者带了高额汇报。据《澳华财经在线》早前报道,今年3月,鉴于昂克素尔全球临床试验持续取得积极进展,并不断取得高质量临床数据,澳大利亚知名券商Bell Potter在最新的分析报告中,对昂克素尔公司股票给出“买入”的建议,目标价格定为0.41澳元。
2015年完成的4项研究表明,OncoSil™在治疗胰腺癌和原发性肝癌(HCC) 方面具有巨大潜力,仅在美国和欧盟市场,每年新增的超过13万案例中将有超过7万名病人符合条件并可从OncoSil™设备治疗中获益。若按现有方案将治疗价格定在2.5万美元/人 (与市场其他医疗设备保持一致),这意味着昂克素尔将在这个超过20亿美元的全球市场中拥有不可替代的优势。







 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


